INTRODUCCIÓN
Candida albicans es un hongo ascomiceto diploide, con un diámetro celular de 2-4 µm (1), que coloniza zonas cálidas y húmedas del organismo humano, como la cavidad oral, el tracto gastrointestinal y la vagina, donde coexiste como comensal sin causar daño en condiciones de salud óptima (2). Su adaptabilidad a la temperatura corporal (37°C) y su capacidad para alternar entre formas morfológicas levadura, pseudohifas e hifas filamentosas son claves para su supervivencia como parte de la microbiota normal (2). No obstante, este equilibrio se altera cuando factores como inmunosupresión, uso prolongado de antibióticos o cambios en la microbiota permiten su transición a patógeno oportunista. En este escenario, C. albicans despliega una patogenicidad multifactorial. Esta progresión explica su rol como principal agente de infecciones fúngicas a nivel global (70% de los casos) con manifestaciones clínicas que van desde la candidiasis oral o vaginal hasta la sepsis fúngica en pacientes críticos (3).
Por lo que, su versatilidad morfológica y su capacidad para modulares respuestas inmunitarias, inmunomodulación mediante proteínas como Cand a 1 y Cand a 3) (2) lo consolidan como un patógeno de alto impacto en salud pública. La distribución geográfica de Candida albicans como patógeno predominante presenta variaciones significativas entre regiones. Mientras en Estados Unidos, Europa y Australia su frecuencia oscila entre 78-89% (4), en América del Sur su predominio es aún más marcado, ocupando el primer lugar en procesos infecciosos. En Argentina, por ejemplo, la candidiasis vaginal en mujeres gestantes alcanza 90,4%, mientras que en pacientes con infecciones sistémicas en unidades de cuidados intensivos su incidencia es del 48,6% (5). En Chile, un estudio multicéntrico reportó 384 casos de candidemia en 18 hospitales, con 65% de afectados adultos y una prevalencia del 39% (6). Brasil, se registró una incidencia del 35,3% en candidiasis vaginal de gestantes, aunque esta cifra contrasta con estudios en otros países de la región, donde su predominio supera el 70% (5).
En Ecuador, Candida albicans es el principal agente etiológico de infecciones fúngicas, con una prevalencia del 21,9-25,9% en candidiasis vaginal de mujeres embarazadas en Quito, seguido por especies no albicans como C. glabrata y C. tropicalis. En adultos mayores con prótesis dentales removibles, su colonización oral alcanza 76,7%, destacando su asociación con factores como el uso prolongado de antibióticos y condiciones inmunosupresoras. Aunque no es enfermedad de reporte obligatorio, estudios locales indican que el 80% de las vaginitis en mujeres en edad fértil se atribuyen a esta especie, con mayor incidencia en zonas rurales y poblaciones con acceso limitado a diagnósticos precisos. La resistencia a antifúngicos no está ampliamente documentada en C. albicans, pero su predominio en contextos hospitalarios y su capacidad para colonizar superficies médicas (ej. prótesis) reflejan su adaptabilidad ecológica y su impacto en salud pública, especialmente en grupos vulnerables (7).
Aunque las infecciones por Candida albicans se tratan tradicionalmente con antifúngicos como anfotericina B y ketoconazol, su uso indiscriminado ha generado resistencia clínica, reduciendo su eficacia terapéutica (7). Este escenario crítico agudizado por la selección de cepas resistentes y la sobreexpresión de bombas de eflujo (ej. ABC transportadores) o mutaciones en genes de síntesis de ergosterol ha impulsado la búsqueda de alternativas terapéuticas. Entre ellas, el extracto de Laurus nobilis (laurel) destaca por su acción antifúngica multifactorial: inhibe el crecimiento mediante compuestos como 4-metilcatecol y farnesol, induce estrés oxidativo en las células del hongo, y altera la integridad de la membrana celular. Estudios como los de Whaley et al. (8) y Latti et al. (9) validan su potencial, aunque su eficacia en cepas resistentes a azoles donde predominan mecanismos como la sobreexpresión de bombas ABC aún requiere evaluación. La combinación de estos hallazgos con estrategias como pruebas de susceptibilidad podría optimizar tratamientos, priorizando recursos naturales accesibles frente a la creciente resistencia a fármacos sintéticos.
Por tanto, el estudio de Candida albicans es fundamental para comprender su dualidad como comensal y patógeno, así como su impacto en la salud pública. Su genoma dinámico y mecanismos de resistencia (como la sobreexpresión de bombas ABC o mutaciones en genes de ergosterol) explican su adaptabilidad a tratamientos antifúngicos, lo que exige estrategias diagnósticas precisas y terapias innovadoras. Además, su virulencia multifactorial incluyendo adhesinas, dimorfismo y enzimas líticas permite colonizar mucosas y evadir respuestas inmunitarias, especialmente en pacientes inmunocomprometidos. La identificación de serotipos (ej. serotipo B en VIH) y especies emergentes (como C. glabrata o C. tropicalis) es clave para guiar tratamientos y prevenir resistencia. Finalmente, su estudio contribuye a desarrollar alternativas terapéuticas basadas en recursos naturales (ej. extractos de Laurus nobilis), priorizando accesibilidad y eficacia frente a la creciente resistencia a fármacos sintéticos (10).
Además, Candida albicans representa un desafío sanitario multifacético, desde infecciones superficiales hasta cuadros sistémicos graves. En mucosas y piel, causa síntomas como prurito, erupciones rojas y secreciones espesas (ej. candidiasis vaginal, intertrigo), con mayor incidencia en diabéticos, obesos o inmunosuprimidos (1, 4). En pacientes críticos, su diseminación (candidemia) tiene mortalidad del 40%, asociada a factores como catéteres, ventilación mecánica o uso prolongado de antibióticos, que alteran la microbiota y favorecen su crecimiento. Además, su dimorfismo (levadura vs. hifas) y formación de biopelículas dificultan tratamientos, perpetuando recaídas y resistencia a antifúngicos como el fluconazol (11).
Además, la subnotificación y diagnóstico tardío agravan su impacto: en candidiasis vaginal, síntomas como ardor al orinar o flujo blanco suelen atribuirse a otras patologías, retrasando intervenciones (6, 7). En pacientes oncológicos, su asociación con inflamación crónica y producción de carcinógenos (ej. acetaldehido) sugiere un rol en la progresión de neoplasias, aunque mecanismos como la inducción de citoquinas proinflamatorias aún requieren validación. Además, dieta rica en azúcares y estrés prolongado favorecen su proliferación, exigiendo enfoques preventivos que integren equilibrio microbiota-intestina y manejo de comorbilidades. Estos retos reflejan la necesidad de protocolos estandarizados y alternativas terapéuticas (ej. extractos naturales), priorizando poblaciones vulnerables (12-15).
De acuerdo a lo anteriormente expuesto, en Ecuador y otros países latinoamericanos, la resistencia a antifúngicos sintéticos (ej. fluconazol) y la alta mortalidad asociada a candidemia exigen alternativas accesibles y de bajo costo, por lo que, ¿El extracto etanólico de Laurus nobilis (laurel) exhibe actividad antifúngica in vitro contra cepas clínicas de Candida albicans, demostrando eficacia comparable o superior a antifúngicos convencionales como el ketoconazol, y cuál es el mecanismo de acción predominante (inhibición del crecimiento, alteración de la membrana celular o interferencia en la formación de biopelículas)?. Por esta razón el presente estudio tiene como objetivo evaluar el efecto antifúngico in vitro del extracto de laurel "Laurus nobilis" frente a la Candida albicans
MATERIALES Y MÉTODOS
Se realizó un estudio experimental, con enfoque cuantitativo, cuya clasificación pertenece a un experimento puro, con un muestreo no probabilístico por conveniencia, a partir de una población de estudio comprendida por 2 cepas comerciales de Candida albicans ATCC 10231 y el extracto de Laurus nobilis seleccionadas por su relevancia epidemiológica (1, 3); la misma, que fue llevada a cabo en las instalaciones del CITT de la Universidad Católica de Cuenca.
Las hojas de laurel fueron recolectadas de un vivero, ubicado en la provincia de Saraguro. La autenticación de la muestra fue realizada por una bióloga, quien llevó a cabo un análisis detallado de las características morfológicas de las hojas, incluyendo la nerviación y las propiedades organolépticas. Para asegurar la calidad de las hojas, se seleccionaron aquellas que no presentaban manchas solares, rasgaduras ni imperfecciones. En total, se recolectaron 941,1 g de hojas, las cuales fueron sometidas a un lavado exhaustivo con agua potable y agua destilada, con el objetivo de eliminar cualquier residuo presente en ellas.
Posterior a ello, se sometió a la materia prima a un proceso de secado, el cual consistió en colocar 469g de la misma en dos equipos distintos. El primer equipo fue un liofilizador de la marca Alpha 1-4 LD plus, cuya temperatura giraba en torno a -70°C. El segundo equipo fue una estufa de aire forzado perteneciente a la marca Memmert, cuya temperatura fue de 60°C. Ambos equipos proporcionaron un producto final seco, el cual se obtuvo al cabo de 49 horas en el primer equipo y, a las 18 horas en el segundo equipo.
Una vez obtenida la materia prima seca, se la sometió a maceración. Para ello, se utilizó alcohol potable al 96%, realizando 3 diluciones en proporciones de 1:10, 1:6 y 1:3. Dichas diluciones reposaron durante un mes en frascos de vidrio ámbar, almacenados en un lugar oscuro y fresco con el fin de garantizar la estabilidad de las mismas. Acto seguido, se realizó una doble filtración del extracto y se lo sometió al rotaevaporador, con el objetivo de eliminar todo el alcohol y dejar únicamente un extracto puro.
Concluido el procedimiento de extracción, se utilizó el método de difusión en disco utilizando la técnica de Kirby-Bauer para evaluar la inhibición del crecimiento de la cepa ATCC 10231 frente al extracto de Laurus nobilis. Para ello, se realizaron diluciones de 100%, 75%, 50% 25% y 10% del extracto de Laurus nobilis con dimetilsulfóxido (DMSO), colocando así en cada disco una concentración total de 25ul. Los medios de cultivo a utilizar fueron de Agar Sabouraud, y el proceso de siembra se ajustó a la escala estándar de McFarland correspondiente a 0,5. Se siguieron los criterios de inclusión y exclusión Tabla 1.
Aquí, se evaluaron un total de 20 placas Petri, de las cuales, la mitad tuvo como control positivo a la anfotericina b con una concentración de 20 ul y, la otra mitad, tuvo como control positivo al ketoconazol con una concentración de 10 ul. Sin embargo, las 20 placas tuvieron como control negativo al dimetilsulfóxido (DMSO) con una concentración de 25ul. Su incubación fue de 37°C por 48 horas y su susceptibilidad se analizó gracias a las pautas de Duraffourd.
Validez interna:
Control de variables: Uso de cepas ATCC (C. albicans ATCC 10231) como referencia para garantizar reproducibilidad (1, 3).
Técnicas estandarizadas: Métodos como difusión en agar (halos de inhibición) o macrodilución en caldo para medir actividad antifúngica (2, 6).
Controles positivos: Inclusión de antifúngicos como ketoconazol y anfotericina b para comparar eficacia (1, 3).
Validez externa:
Limitaciones: La mayoría de estudios usan cepas ATCC, no clínicas, lo que reduce su aplicabilidad en contextos reales (3, 6).
Generalización: Resultados pueden extrapolarse a formulaciones similares (ej. cremas), pero no a otros tipos de extractos (ej. aceites esenciales) (1, 4).
En cuanto al procesamiento de datos, se utilizó el programa Microsoft Office Excel, versión 2020 y, el análisis estadístico se generó en el programa SPSS 26.0.
RESULTADOS Y DISCUSIÓN
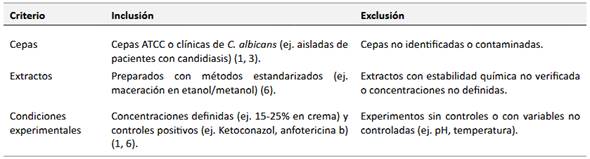
Para los halos observados, la dilución 1:10 sometida a maceración y secado en estufa de aire forzado demostró ser la más efectiva para inhibir el crecimiento de Candida albicans. Este hallazgo se evidenció en la Figura 1, donde se observó un halo de inhibición significativamente mayor en comparación con las diluciones 1:6 y 1:3, tanto en muestras secadas en estufa como en liofilizador. La superioridad de la dilución 1:10 se atribuye a una optimización en la concentración de compuestos bioactivos (fenólicos, terpenos) durante el proceso de maceración, lo que potenció su actividad antifúngica. Por esta razón, se seleccionó esta dilución para los análisis posteriores, garantizando la reproducibilidad y eficacia de los métodos descritos en la investigación.
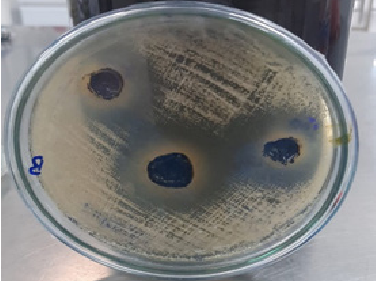
Además, la Figura 2 documenta la reconstitución exitosa de Candida albicans ATCC 10231 en un cultivo primario, confirmando la ausencia de contaminación y la viabilidad del material biológico utilizado. Este hallazgo se evidencia mediante el crecimiento fructífero y homogéneo de las colonias, lo que valida la pureza de la cepa y la eficacia del protocolo de reactivación. La integridad del cultivo primario es fundamental para garantizar la reproducibilidad de los ensayos antifúngicos posteriores, asegurando que los resultados reflejen la acción real del extracto de Laurus nobilis sobre el hongo, sin interferencias externas.
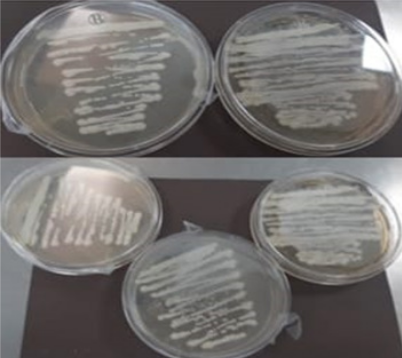
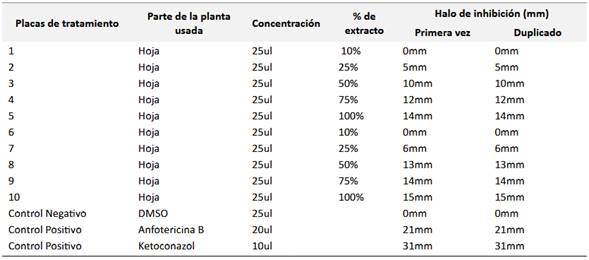
En este sentido, una vez reactivada la cepa ATCC 10231, se prepararon 20 placas Petri en duplicado para garantizar la reproducibilidad de los resultados. Cada placa se inoculó con Candida albicans y se aplicaron diferentes concentraciones del extracto de Laurus nobilis (100%, 75%, 50%, 25% y 10%), junto a controles positivos (anfotericina B y ketoconazol) para comparar su eficacia antifúngica. Este diseño permitió evaluar la relación dosis-respuesta del extracto y su potencial como alternativa terapéutica frente a fármacos convencionales, cuyos resultados se detallan en las Figura 3.
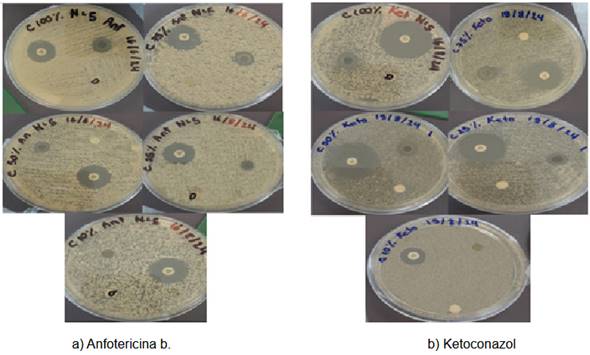
Mientras que, en la Tabla 2 sintetiza los halos de inhibición obtenidos en las diferentes concentraciones del extracto de Laurus nobilis (100%, 75%, 50%, 25% y 10%), comparados con los antifúngicos de referencia (anfotericina B y ketoconazol). Estos datos permiten confirmar que el extracto exhibe un efecto antifúngico significativo frente a Candida albicans, con una relación dosis-dependiente: las concentraciones más altas (100% y 75%) generaron halos mayores, mientras que las diluciones inferiores (25% y 10%) mostraron menor inhibición.
En este sentido, este patrón sugiere que compuestos bioactivos como el 4-metilcatecol y el farnesol, presentes en el extracto, actúan sobre la membrana celular o la síntesis de pared del hongo, limitando su crecimiento. La comparación con antifúngicos sintéticos (ketoconazol y anfotericina b) revela que, aunque su eficacia es menor, el extracto podría ser una alternativa viable en contextos con resistencia a fármacos o recursos limitados. De acuerdo con la escala de Duraffourd, el extracto de Laurus nobilis al 100% mostró halos de inhibición entre 15 mm y 14 mm, lo que lo clasifica como sensible frente a Candida albicans. La concentración al 75% también presentó una respuesta categorizada como sensible, con zonas de inhibición que oscilaron entre 14 mm y 12 mm. En el caso del extracto al 50%, los halos fluctuaron entre 13 mm y 10 mm, permaneciendo dentro del rango de sensibilidad, aunque con una eficacia ligeramente menor en comparación con las concentraciones más altas.
Por otro lado, las diluciones al 25% y 10% mostraron halos de inhibición entre 6 mm y 0 mm, lo que indica una respuesta nula o insuficiente para inhibir el crecimiento del hongo. Estos resultados evidencian una relación dosis-dependiente, donde las concentraciones más elevadas del extracto presentan una actividad antifúngica significativa, mientras que las diluciones más bajas pierden efectividad. La clasificación como sensible en las concentraciones superiores sugiere que los compuestos bioactivos presentes en el extracto, como el 4-metilcatecol, farnesol y acetato de bornilo, actúan sobre la membrana celular o interfieren en la síntesis de componentes esenciales del hongo. Sin embargo, la pérdida de actividad en las concentraciones más bajas podría deberse a una disminución en la cantidad efectiva de dichos compuestos. Esto refuerza la importancia de mantener concentraciones adecuadas para garantizar un efecto antifúngico óptimo.
Discusión
Los resultados obtenidos en este estudio demuestran que el extracto de Laurus nobilis al 100%, 75% y 50% posee efecto antifúngico frente a Candida albicans, debido a que sus halos de inhibición presentaron sensibilidad de acuerdo con la escala de Duraffourd. Este hallazgo es consistente con los reportados por Abdullah Al-Omran et al. (16), quienes, al realizar una evaluación del extracto etanólico de Laurus nobilis, señalaron una destacada actividad antimicrobiana contra bacterias Gram-positivas y Gram-negativas, así como contra el hongo Candida albicans. En su estudio, las zonas de inhibición oscilaron entre 4,66 y 33,3 mm, con mayor inhibición en Saccharomyces cerevisiae (33,3 mm) y Candida albicans (16,4 mm).
Por tanto, la eficacia antifúngica observada puede atribuirse a la presencia de compuestos bioactivos en el extracto de L. nobilis. Estudios recientes han identificado el isoeugenol (53,49%) como el componente principal del aceite esencial de laurel, junto con otros compuestos como 1,8-cineol (31,48-45,01%) y α-terpinyl acetato. Estos componentes, especialmente los monoterpenos y sesquiterpenos, pueden afectar la biosíntesis de la pared celular y la permeabilidad de la membrana de C. albicans, lo que explica su actividad antifúngica (5). Además, se ha demostrado que el aceite esencial de L. nobilis no solo inhibe el crecimiento planctónico de C. albicans, sino que también interfiere con la formación de biopelículas y reduce la adhesión inicial de las células fúngicas. Esta actividad anti-biopelícula es particularmente relevante en el contexto clínico, ya que las biopelículas de Candida son notoriamente resistentes a los tratamientos antifúngicos convencionales (1).
Es importante destacar que la actividad antifúngica del extracto de L. nobilis se ha observado en concentraciones relativamente bajas, con valores de concentración mínima inhibitoria (MIC) que oscilan entre 250 y 500 μg/mL. Esto sugiere que el extracto podría ser una alternativa prometedora a los antifúngicos sintéticos, especialmente en casos de resistencia a los medicamentos convencionales o en entornos con recursos limitados. En contraste, Al-Hussaini et al. (17), al evaluar 24 extractos de diferentes solventes (acuoso, etanol, butanol, hexano, cloroformo y metanol) derivados de hojas, corteza, flores y frutos de Laurus nobilis frente a siete microorganismos, reportaron que el extracto etanólico de hojas de laurel produjo un halo de inhibición de 11 mm frente a Candida albicans, clasificado como "bueno" según su escala. Este resultado, sugiere variabilidad en la eficacia según el método de extracción y la procedencia botánica. Sin embargo, destacó que los extractos etanolico y hexánico (tanto de hojas como de corteza) exhibieron actividad antifúngica superior a la nistatina, un antifúngico convencional.
Esta superioridad podría atribuirse a la sinergia de compuestos bioactivos como isoeugenol (53,49%), 1,8-cineol (31,48-45,01%) y α-terpinil acetato, identificados en el aceite esencial de laurel. Estos monoterpenos y sesquiterpenos alteran la permeabilidad de la membrana celular y la biosíntesis de la pared fúngica, mecanismos respaldados por estudios que demuestran un efecto inhibitorio sobre biopelículas de C. albicans. Adicionalmente, la polaridad del solvente influye en la extracción de metabolitos: el hexano (no polar) favorece la obtención de terpenoides lipofílicos, mientras el etanol (polar) extrae flavonoides y alcaloides, ampliando el espectro antimicrobiano.
Por su parte, Mohamed Noha M et al. (10) destacan la actividad antifúngica y antioxidante del extracto de hojas de Laurus nobilis frente a Candida albicans, respaldada por la presencia de halos de inhibición a concentraciones de 10 mg/dL. Esta eficacia se atribuye a compuestos bioactivos como 4-metilcatecol, fitol, hidrato cis-sabinen, éter quercetintetrametílico, dimetoxi-3-hidroxiflavona, farnesol y acetato de bornilo, que actúan mediante mecanismos como la alteración de la membrana celular y la interferencia en la síntesis de pared fúngica (2, 6). Por ejemplo, el farnesol un sesquiterpeno inhibe la adhesión inicial de C. albicans y reduce la formación de biopelículas, mientras que el 4-metilcatecol induce estrés oxidativo en el hongo (2, 6).
En contraste, Dastan et al. (18) reportan una ausencia de inhibición de C. albicans por el extracto etanólico de laurel, al no observarse halos de inhibición en el medio utilizado. Esta discrepancia podría explicarse por variaciones metodológicas, como diferencias en el tipo de solvente (etanol vs. otros), concentraciones (10 mg/dL vs. valores inferiores) o cepas de Candida evaluadas (clínicas vs. ATCC) (1, 3). Además, factores como la polaridad del solvente influyen en la extracción de metabolitos: el etanol favorece la obtención de flavonoides y alcaloides, mientras que solventes no polares (hexano) priorizan terpenos lipofílicos (6). La actividad antioxidante del laurel, mencionada por Mohamed Noha M et al. (10) también juega un rol indirecto en su eficacia antifúngica, al neutralizar especies reactivas de oxígeno (ROS) que favorecen la supervivencia del hongo. Sin embargo, la ausencia de inhibición reportada por Dastan et al. (18) subraya la necesidad de protocolos estandarizados para evaluar extractos vegetales, incluyendo pruebas de susceptibilidad y análisis fitoquímicos detallados.
Por su parte, Fidan et al. (11) observaron que los componentes antioxidantes del extracto de hojas de Laurus nobilis generan estrés oxidativo en células de Candida albicans, lo que implica la pérdida de funciones celulares y la inhibición del crecimiento fúngico. Este fenómeno se atribuye principalmente a la presencia de fenoles como el eugenol, que penetran la célula fúngica y provocan la acumulación excesiva de radicales libres de oxígeno (ROS) (19). Estos radicales causan daños oxidativos en proteínas, ADN y lípidos de la membrana celular, alterando su integridad y función (20). Por otro lado, Üreyen Esertaş et al. (12) demostraron el efecto antimicrobiano del extracto de L. nobilis frente a diversos microorganismos, incluyendo bacterias Gram positivas, Gram negativas y hongos. La actividad se relaciona con el tipo de diluyente utilizado y los halos de inhibición formados. Entre los microorganismos evaluados, Candida albicans y Mycobacterium smegmatis mostraron los mayores halos de inhibición (13,66 mm y 24,66 mm, respectivamente), lo que sugiere una eficacia diferencial según el patógeno.
CONCLUSIONES
Los resultados del presente estudio demuestran que el extracto de Laurus nobilis exhibe un efecto antifúngico significativo frente a Candida albicans, atribuible a la sinergia de compuestos bioactivos (4-metilcatecol, farnesol, acetato de bornilo) presentes en sus hojas. La optimización de procesos de extracción (maceración y secado en estufa de aire forzado) permitió concentrar estos metabolitos, potenciando su actividad. Este hallazgo adquiere relevancia en el ámbito clínico, ya que ofrece una alternativa viable a antifúngicos sintéticos, especialmente en contextos con resistencia emergente o acceso limitado a tratamientos convencionales.
Además, la acción multifactorial del extracto que incluye inhibición del crecimiento planctónico, interferencia en biopelículas e inducción de estrés oxidativo sugiere un mecanismo terapéutico robusto. Sin embargo, su aplicación práctica requiere estudios in vivo y ensayos clínicos para validar su seguridad y eficacia en humanos. La integración de recursos naturales como el laurel en protocolos terapéuticos podría mitigar riesgos de resistencia y promover enfoques sostenibles, alineándose con la necesidad global de alternativas accesibles frente a patógenos fúngicos.